El rol del banco de yemas en la tolerancia a glifosato de dos especies herbáceas
DOI:
https://doi.org/10.31055/1851.2372.v54.n4.24301Palabras clave:
Commelina erecta, Eustachys retusa, herbicida,, malezas, regeneraciónResumen
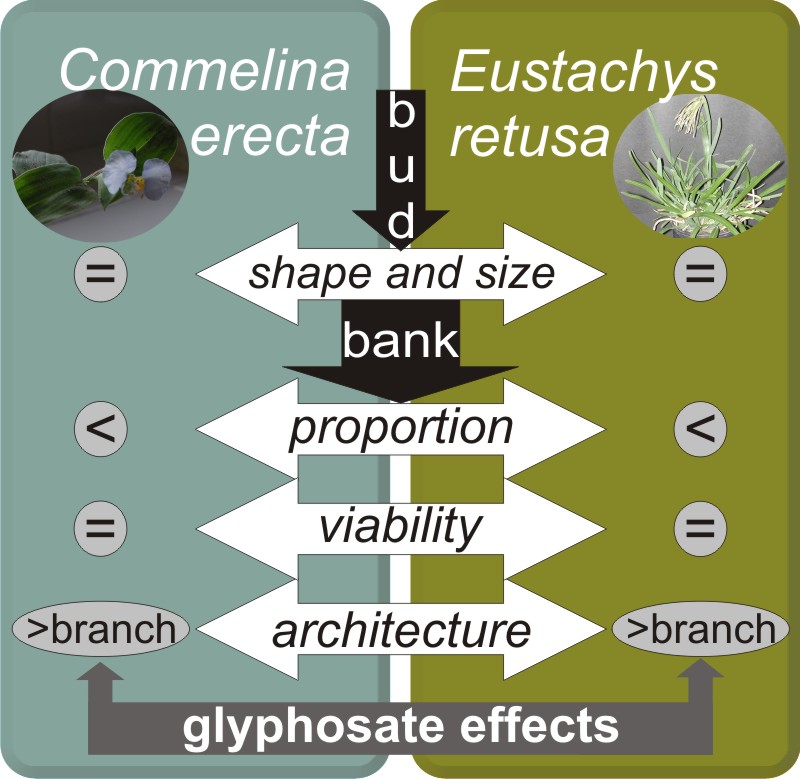
Introducción y objetivos: Commelina erecta y Eutsachys retusa son malezas perennes tolerantes a glifosato. El propósito de este estudio fue caracterizar el banco de yemas de ambas especies y evaluar su respuesta a la aplicación de glifosato.
M&M: Se analizaron yemas de 120 ejes reproductivos de C. erecta y 80 ejes reproductivos de E. retusa, a los 30 y 60 días después de la aplicación del herbicida. Las dosis empleadas en C. erecta fueron 0 (control), 1.200 y 2.400 g a.i. ha -1 y en E. retusa fueron 0 (control), 480 y 1200 g a.i. ha -1.
Resultados: Ambas especies presentaron yemas activas en aproximadamente el 50% de los nudos, incluso después de la aplicación del herbicida. Ambas malezas alteraron la dinámica del banco de yemas y su patrón de crecimiento post-aplicación del herbicida. Es decir, la activación de yemas originalmente inhibidas permitió que ambas malezas rebroten y sobrevivan, alterando su arquitectura.
Conclusiones: El banco de yemas juega un papel importante en la tolerancia a Glifosato en ambas malezas. En ambas especies, la capacidad de rebrote fue similar en cualquiera de las dosis de glifosato aplicadas; por lo tanto, una estrategia de control que aumente la dosis de herbicida no sería una alternativa exitosa para el manejo de estas malezas. La interrupción del almacenamiento de reservas en el sistema de rizomas y la reducción de la cantidad de yemas, serían factores claves para un manejo efectivo a largo plazo de estas y otras malezas perennes, en un sistema de labranza cero.
Referencias
BOND, W. J. & J. J. MIDGLEY. 2001. Ecology of sprouting in woody plants: the persistence niche. Trends Ecol. Evol. 16: 45-51. https://doi.org/10.1016/S0169-5347(00)02033-4
BONSER, S. P. & L. W. AARSSEN. 2009. Interpreting reproductive allometry: Individual strategies of allocation explain size-dependent reproduction in plant populations. Perspect. Pl. Ecol. Evol. Syst. 1: 31-40. https://doi.org/10.1016/j.ppees.2008.10.003
BOSTRÖM, U., L. ANDERSSON, J. FORKMAN, I. HAKMAN, J. LIEW & E. MAGNUSKI. 2013. Seasonal variation in sprouting capacity from intact rhizome systems of three perennial weeds. Weed Res. 53: 387–398. https://doi.org/10.1111/wre.12035
BURKART, A. 1969. Flora Ilustrada de Entre Ríos (Argentina). T. VI, Parte II. Colección Científica del INTA, Buenos Aires.
BUSSO, C. A., R. J. MUELLER & J. H. RICHARDS. 1989. Effects of drought and defoliation on bud viability in two caespitose grasses. Ann. Bot. 63: 477-485. https://doi.org/10.1093/oxfordjournals.aob.a087768
BUSSO, C. A., J. H. RICHARDS & N. J. CHATTERTON. 1990. Nonstructural carbohydrates and spring regrowth of two cool-season grasses: Interaction of drought and clipping. J. Range. Managem. 43: 336-343. https://doi.org/10.2307/3898928
BUSSO, C. A., C. GITTINS, G. F. BECKER & L. GHERMANDI. 2011. Tiller hierarchy and defoliation frequency determine bud viability in the grass Poa ligularis. Ecol. Res. 26: 985-997. https://doi.org/10.1007/s11284-011-0857-9
CASAFE (Cámara de Sanidad Agropecuaria y Fertilizantes- República Argentina). 2017. Guía de productos fitosanitarios para la República Argentina. 18th ed. Buenos Aires, Argentina
DELLAFERRERA, I. M., N. J. GUARISE & A. AMSLER. 2007. Relevamiento de malezas en cultivos de soja en sistema de siembra directa con glifosato del departamento San Justo (Provincia de Santa Fe). Revista FAVE –Sección Agrarias 5/6: 15-25. https://doi.org/10.14409/fa.v5i1/2.1318
DELLAFERRERA, I. M., E. S. PANIGO, F. GONZALEZ-TORRALBA, R. A. DE PRADO, P. J. CHRISTOFFOLETI & M. G. PERRETA. 2015. Características estructurales y fisiológicas de Petunia axillaris relacionadas con su baja sensibilidad a glifosato. Revista Pl. Danin 33: 451-462. https://doi.org/10.1590/S0100-83582015000300008
DEMETRIO, G. R., F. F. COELHO & M. E. BARBOSA. 2014. Body size and clonality consequences for sexual reproduction in a perennial herb of Brazilian rupestrian grasslands. Brazil. J. Biol 74: 744-749. https://doi.org/10.1590/bjb.2014.0070
DENG, Z., X. CHEN, Y. XIE, X. LI, Y. PAN & F. LI. 2013. Effects of size and vertical distribution of buds on sprouting and plant growth of the clonal emergent macrophyte Miscanthus sacchariflorus (Poaceae). Aquatic Bot. 104: 121-126. https://doi.org/10.1016/j.aquabot.2012.08.004
FOURCAUD, T., X. ZHANG, A. STOKES, H. LAMBERS & C. KÖRNER. 2008. Plant Growth Modelling and Applications: The Increasing Importance of Plant Architecture in Growth Models. Ann. Bot.101: 1053-1063. https://doi.org/10.1093/aob/mcn050
HARPER, J. L. 1977. Population biology of plants. 1st ed. Academic Press, Lodon.
HENDRICKSON, J. R. & D. D. BRISKE. 1997. Axillary bud banks of two semiarid perennial grasses: occurrence, longevity, and contribution to population persistence. Oecologia 110: 584-591. https://doi.org/10.1007/s004420050199
HOTHORN, T., F. BRETZ & P. WESTFALL. 2008. Simultaneous inference in general parametric models. Biometr. J. 50: 346-363. https://doi.org/10.1002/bimj.200810425
KLIMEŠOVÁ, J. & L. KLIMEŠ. 2003. Resprouting of herbs in disturbed habitats: is it adequately described by Bellingham–Sparrow’s model? OIKOS 103: 225-229. https://doi.org/10.1034/j.1600-0706.2003.12725.x
KLIMEŠOVÁ, J. & J. MARTÍNKOVÁ. 2004. Intermediate growth forms as a model for the study of plant clonality functioning: an example with root sprouters. Evol Ecol 18: 669-681. https://doi.org/10.1007/s10682-004-5149-1
KLIMEŠOVÁ, J. & L. KLIMEŠ. 2007. Bud banks and their role in vegetative regeneration– A literature review and proposal for simple classification and assessment. Perspect. Pl. Ecol. Evol. Syst 8: 115-129. https://doi.org/10.1016/j.ppees.2006.10.002
KLIMEŠOVÁ, J., V. LATZEL, F. DE BELLO & J. M. VAN GROENENDAEL. 2008. Plant functional traits in studies of vegetation changes in response to grazing and mowing: towards a use of more specific traits. Preslia 80: 245-253.
MALPASSI, R. 2005. Efectos de la aplicación de quizalofop sobre la arquitectura y anatomía foliar de Eleusine indica. Agriscientia 22: 55-62. http://dx.doi.org/10.31047/1668.298x.v22.n2
MOREIRA, B., J. TORMO & J. G. PAUSAS. 2012. To resprout or not to resprout: factors driving intraspecific variability in resprouting. Oikos 121: 1577-1584. https://doi.org/10.1111/j.1600-0706.2011.20258.x
NISENSOHN, L., D. TUESCA, D. FACCINI, E. PURICELLI & J. VITTA. 2011. Factores biológicos que determinan la competencia de Commelina erecta con otras malezas en sistemas de cultivo. Revista Pl. Danin 29: 97-106. https://doi.org/10.1590/S0100-83582011000100012
OTT, J. P. & D. C. HARTNETT. 2015. Bud-bank and tiller dynamics of co-occurring C3 caespitose grasses in mixed-grass prairie. Amer. J. Bot. 102: 1462-1471. https://doi.org/10.3732/ajb.1500039
PANIGO, E. S., I. M. DELLAFERRERA, J. M. ACOSTA, A. G. BENDER, J. I. GARETTO & M. G. PERRETA. 2012. Glyphosate-induced structural variations in Commelina erecta L. (Commelinaceae). Ecotoxicol. Environm. Safety 76: 135-142. https://doi.org/10.1016/j.ecoenv.2011.10.002
PANIGO, E. S., C. A. ALESSO, I. M. DELLAFERRERA, J. OLIVELLA & M. G. PERRETA. 2016. Morpho-architectural traits that allow the regeneration of Eustachys retusa (Poaceae) in systems with intensive glyphosate application. Revista Pl. Danin 34: 709-719. https://doi.org/10.1590/s0100-83582016340400011
PANIGO, E. S. & L. NISENSOHN. Commelina erecta L. En: FERNÁNDEZ; O. A., E. LEGUIZAMÓN, & H. A. ACCIARESI (ed.) “Malezas e Invasoras de la Argentina” Tomo III, pp. 181-189. Ediuns, Bahía Blanca.
PURICELLI, E. & D. FACCINI. 2005. Control de Eustachys retusa y Chloris barbata con glifosato. Soja en siembra directa. AAPRESID Septiembre: 112-123.
R DEVELOPMENT CORE TEAM. 2014. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051-07-0, Disponible en: http://www.R-project.org/.]
RAINERO, H. 2004. Avances en el control de malezas con tolerancia al glifosato. Bol. INTA- EEA Manfredi 12: 5-12.
SHIMIZU-SATO, S. & H. MORI. 2001. Control of outgrowth and dormancy in axillary buds. Pl. Physiol 127: 1405-1413. https://doi.org/10.1104/pp.010841
VESK, P. A. & M. WESTOBY. 2004. Sprouting ability across diverse disturbances and vegetation types worldwide. J. Ecol. 92: 310-320. https://doi.org/10.1111/j.0022-0477.2004.00871.x
VESK, P. A., D. I. WARTON & M. WESTOBY. 2004. Sprouting by semi-arid plants: testing a dichotomy and predictive traits. OIKOS 107: 72-89. https://doi.org/10.1111/j.0030-1299.2004.13122.x
WALDIE, T., A. HAYWARD & C. A. BEVERIDGE. 2010. Axillary bud outgrowth in herbaceous shoots: how do strigolactones fit into the picture? Pl. Molec. Biol. 73: 27-36. https://doi.org/10.1007/s11103-010-9599-2
Publicado
Número
Sección
Licencia
El Bol. Soc. Argent. Bot.:
- Provee ACCESO ABIERTO y gratuito inmediato a su contenido bajo el principio de que hacer disponible gratuitamente la investigación al público, lo cual fomenta un mayor intercambio de conocimiento global.

- Permite a los autores mantener sus derechos de autor sin restricciones.
- El material publicado en Bol. Soc. Argent. Bot. se distribuye bajo una licencia de Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional.






