Detección de hongos micorrícicos arbusculares en la hojarasca de distintas especies arbóreas: evaluación de tres técnicas de clarificación.
DOI:
https://doi.org/10.31055/1851.2372.v58.n2.37810Palavras-chave:
clarificación, estructuras fúngicas, histoquímica, hojarasca, hongos micorrícicos arbuscularesResumo
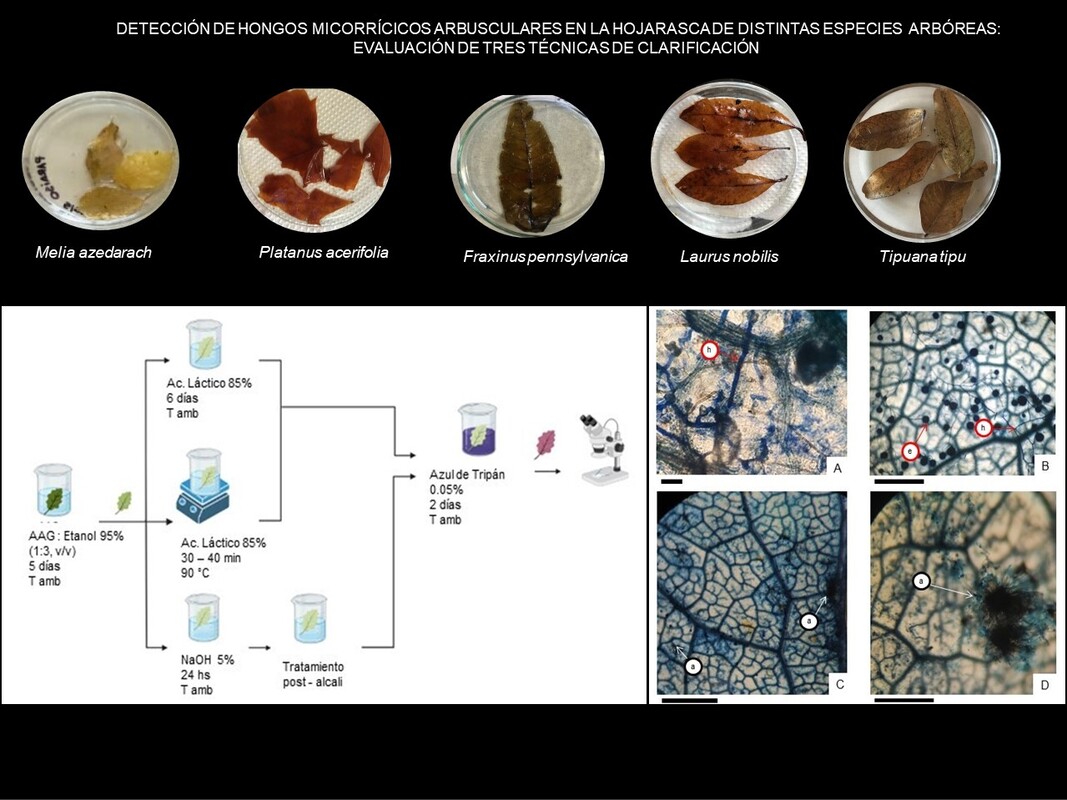
Introducción y objetivos: Los hongos micorrícicos arbusculares (HMA) forman asociaciones simbióticas mutualistas con las raíces de las plantas y se desarrollan en el suelo y hojarasca. Hasta el momento, se ha empleado una única técnica de clarificación en hojarasca para el estudio de los HMA, pero dada la gran variabilidad anatómica y bioquímica de las hojas, es necesario analizar otras metodologías. En este trabajo se evaluaron y ajustaron tres técnicas de clarificación en hojarasca de distintas especies arbóreas para la detección de HMA.
M&M: Se recolectó hojarasca de Quercus robur, Tipuana tipu, Ulmus minor, Fraxinus pennsylvanica, Platanus acerifolia, Laurus nobilis, Populus alba and Melia azedarach de la superficie del suelo en dos parques de la ciudad de Buenos Aires. Además, se inoculó hojarasca de F. pennsylvanica con Rhizoglomus intraradices en un cultivo bajo condiciones semicontroladas. Fueron evaluadas tres técnicas de clarificación: “5 – 5 – 5” de Arambarri (2018), Phillips & Hayman (1970) y Peterson et al. (2008), y se ajustaron modificando la duración y condiciones de exposición a los reactivos.
Resultados: La técnica de clarificación propuesta por Peterson et al. (2008) fue la más apropiada para todas las hojarascas evaluadas, dado que se obtuvo una eficaz clarificación, conservación de la estructura foliar y la visualización de esporas e hifas de HMA.
Conclusión: La selección adecuada de la técnica depende de la calidad de la hojarasca. La optimización del método de Peterson et al. (2008) permitió detectar estructuras de HMA en la hojarasca delicada de F. pennsylvanica y T. tipu.
Referências
ARAMBARRI, A.M. 2018. La "técnica de clarificación 5-5-5", un método natural para el tratamiento de material vegetal. Bol. Soc. Argent. Bot. 53: 579-586. http://dx.doi.org/10.31055/1851.2372.v53.n4.21980.
ARISTIZABAL, C., E.L. RIVERA & D.P. JANOS. 2004. Arbuscular mycorrhizal fungi colonize decomposing leaves of Myrica parvifolia, M. pubescens and Paepalanthus sp. Mycorrhiza 14: 221-228. https://doi.org/10.1007/s00572-003-0259-0
BUNN, R.A., D.T. SIMPSON & L.S. BULLINGTON. 2019. Revisiting the 'direct mineral cycling' hypothesis: arbuscular mycorrhizal fungi colonize leaf litter, but why? ISME J. 13: 1891-1898. https://doi.org/10.1038/s41396-019-0403-2
CAO, T., Y. CHENG, Y. FANG, X. KONG, J. YANG, H. ALHARBI, Y. KUZYAKOV & X. TIAN. 2022. Synergy of saprotrophs with mycorrhiza for litter decomposition and hotspot formation depends on nutrient availability in the rhizosphere. Geoderma 410:115662. http://dx.doi.org/10.1016/j.geoderma.2021.115662
CHOWDHURY, S., M. LANGE, A.A. MALIK, T. GOODALL, H. JIANBEI, R.I. GRIFFITHS & G. GLEIXNER. 2022. Plants with arbuscular mycorrhizal fungi efficiently acquire Nitrogen from substrate additions by shaping the decomposer community composition and their net plant carbon demand. Plant Soil 475: 473-490. https://doi.org/10.1007/s11104-022-05380-x
CHURCHLAND, C. & S. GRAYSTON. 2014. Specificity of plant-microbe interactions in the tree mycorrhizosphere biome and consequences for soil C cycling. Front. Microbiol. 5: 261. https://doi.org/10.3389/fmicb.2014.00261
DÍAZ ARIZA, L.A., E.L. RIVERA & N. SÁNCHEZ. 2021. Occurrence of arbuscular mycorrhizal fungi in leaf litter and roots of shaded coffee plantations under organic and conventional management. Rev. Bras. Cienc. Solo 45: e0200110. https://doi.org/10.36783/18069657rbcs20200110
GARDNER, R.O. 1975. An overview of botanical clearing techniques. Stain. Technol. 50: 99-105. https://doi.org/10.3109/10520297509117042
GOUGOULIAS, C., J.M. CLARK & L.J. SHAW. 2014. The role of soil microbes in the global carbon cycle: tracking the below-ground microbial processing of plant-derived carbon for manipulating carbon dynamics in agricultural systems. J. Sci. Food Agric. 94: 2362-71. https://doi.org/10.1002/jsfa.6577
KOBAYASHI, Y., T. MAEDA, K. YAMAGUCHI, H. KAMEOKA, S. TANKA, T. EZAWA, S. SHIGENOBU M. & KAWAGUCHI. 2018. The genome of Rhizophagus clarus HR1 reveals a common genetic basis for auxotrophy among arbuscular mycorrhizal fungi. BMC Genomics 19: 465. https://doi.org/10.1186/s12864-018-4853-0
LINLIN SHI, L., G.G.O. DOSSA, E. PAUDEL, H. ZANG, J. XU & RD. HARRISON. 2019. Changes in fungal communities across a forest disturbance gradient. Appl. Environ. Microbiol. 85: e00080-19. https://doi.org/10.1128/AEM.00080-19
MEI, L., P. ZHANG, G. CUI, X. YANG, T. ZHANG & J. GUO. 2022. Arbuscular mycorrhizal fungi promote litter decomposition and alleviate nutrient limitations of soil microbes under warming and nitrogen application. App. Soil. Ecol. 171: 104318. https://doi.org/10.1016/j.apsoil.2021.104318
PETERSON, R.L., C.A. PETERSON & L.H. MELVILLE. 2008. Teaching plant anatomy through creative laboratory exercises. NRC ResPress. Ottawa, Ontario, Canada.
PHILLIPS, J.M. & D.S. HAYMAN. 1970. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Trans. Brit. Mycol. Soc. 55: 158-161. https://doi.org/10.1016/S0007-1536(70)80110-3
PLENCHETTE, C., & C. MOREL. 1996. External phosphorus requirement of mycorrhizal and non-mycorrhizal barley and soybean plants. Biol. Fertil. Soils 21: 303-308. https://doi.org/10.1007/BF00334907
SMITH, S.E., & D. READ. 2008. Mycorrhizal Symbiosis. 3rd ed. Elsevier Ltd, London.
TISSERANT, E., A. KHOLER, P. DOZOLME-SEDDAS, R. BALLESTRINI… & F. MARTIN. 2011. The transcriptome of the arbuscular mycorrhizal fungus Glomus intraradices (DAOM 197198) reveals functional tradeoffs in an obligate symbiont. New Phytol. 193: 755-769. https://doi.org/10.1111/j.1469-8137.2011.03948.x
VALDÉS, F.E., C. ABARCA, R.P. COLOMBO & V.A. SILVANI. 2020. Capítulo 1: Introducción y generalidades. En: SAPARRAT M.C.N., M.F. RUSCITTI & M.C. ARANGO (eds.). Micorrizas arbusculares: Biología y aplicaciones en el sector agroforestal. Buenos Aires: Editorial Edulp.
Downloads
Publicado
Edição
Seção
Licença
Copyright (c) 2023 Sofía Crescio, Alicia Margarita Godeas, Vanesa Silvani

Este trabalho está licenciado sob uma licença Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
Proporciona ACESSO ABERTO imediato e livre ao seu conteúdo sob o princípio de tornar a pesquisa livremente disponível ao público, o que promove uma maior troca de conhecimento global, permitindo que os autores mantenham seus direitos autorais sem restrições. 
Material publicado em Bol. Soc. Argent. Bot. é distribuído sob uma licença Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License. 




